Teoría Tabla periódica II: Radio atómico. Energía de ionización. Electronegatividad.
➡️ Continuamos con el estudio de la tabla periódica. En este video vamos a estudiar la relación del radio atómico (🕐00:00), la energía de ionización (🕐05:21) y la electronegatividad (🕐08:28) con la ubicación de los elementos en la tabla.
Para que puedas entender mejor te dejo un breve resumen de estos conceptos (y después de este video te dejo un apunte para repasar todo esto):
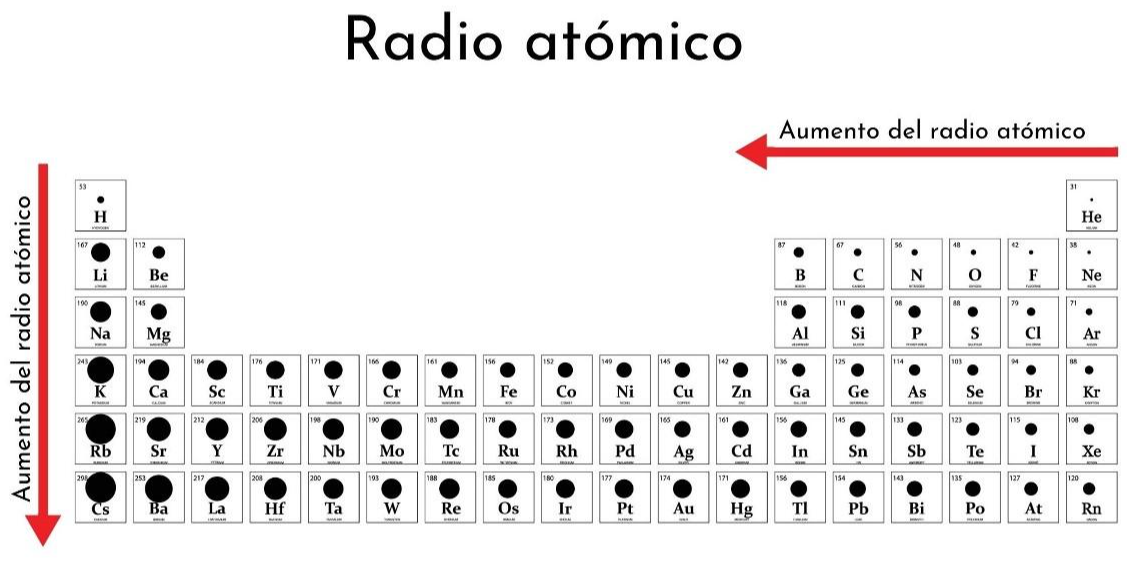
• Radio atómico: Es la distancia promedio entre el núcleo de un átomo y la nube de electrones que lo rodea. Es una medida del tamaño de un átomo.
• Energía de Ionización: Es la cantidad de energía necesaria para remover un electrón de un átomo en estado gaseoso, convirtiéndolo en un ion positivo (catión). Vas a ver que a veces se habla de primer y segunda energía de ionización: La primera energía de ionización se refiere a la energía requerida para remover el primer electrón, mientras que la segunda energía de ionización se refiere a la energía necesaria para remover el segundo electrón, y así sucesivamente.
• Electronegatividad: Es una medida de la tendencia de un átomo a atraer hacia sí los electrones compartidos en un enlace químico.
• Electronegatividad: Es una medida de la tendencia de un átomo a atraer hacia sí los electrones compartidos en un enlace químico.
El navegador de Instagram no reproduce videos, por favor ingresá desde Chrome o Safari.
Acerca del video
Después de este video te dejo un apunte para que termines de integrar estos conceptos 🙌
💡Notá que el H (hidrógeno) se encuentra ubicado en la Tabla Periódica arriba del Li. Esto es por convención únicamente. El H no pertenece al grupo 1, NO ES UN METAL ALCALINO.
🤖
¿Tenés dudas? Pregúntale a ExaBoti
Asistente de IA para resolver tus preguntas al instante🤖
¡Hola! Soy ExaBoti
Para chatear conmigo sobre este contenido necesitas desbloquear el curso

Igual, para que sepas qué es la afinidad electrónica (no suelen tomar esto pero está bueno saberlo) podés pensar en la energía de ionización. Las dos están relacionadas porque dependen de la atracción núcleo-electrón en un átomo, pero miran “caras opuestas” del mismo fenómeno:
La energía de ionización es la energía que hay que aportar para sacar un electrón de un átomo neutro en estado gaseoso.
Confirmar eliminación
¿Estás segurx de que quieres eliminar esta respuesta? Esta acción no se puede deshacer.
Confirmar eliminación
¿Estás segurx de que quieres eliminar esta respuesta? Esta acción no se puede deshacer.
Confirmar eliminación
¿Estás segurx de que quieres eliminar este comentario? Esta acción no se puede deshacer.